
1、项目建设概况
本项目拟由发行人控股子公司负责实施。项目建设地址位于某市,租用一栋闲置科研楼,在该建筑内建设仿制药一致性评价中心,租赁总建筑面积为 10,880 平方米。子公司自身承担评价中心大楼的装修并自行配备相关的仪器设备和相关配套设施。
2、项目的必要性
(1) 项目建设是满足公司发展战略,不断完善公司产业链,发挥渠道协调效益的需要
本公司从药物发现开始覆盖了药品研发的整个环节,并进一步延伸到上市后再评价等后续服务业务,具备为单个客户提供各个环节服务的能力。仿制药一致性评价主要评价的内容是仿制药在体外药学等效即体外溶出曲线与参比试剂的一致性及体内药代动力学等效即体内生物利用度与参比试剂的一致性,从而达到治疗等效即临床疗效一致的目的。本公司作为药品研发服务公司,体外药学评价和生物利用度评价是药物研发不可或缺的环节,具备丰富的实验操作经验和项目管控能力。本项目建设是公司原有业务的延伸,通过项目的建设可以更好地完善公司产业链,为公司的发展提供新的增长点,以提高企业的整体竞争力。
(2) 项目建设是企业满足市场需求、抢占市场先机的需要
仿制药一致性评价需要大量的药学研究和临床研究,综合服务能力将是在竞争中胜出的关键要素。短期来看,未来两到三年将是仿制药一致性评价的高峰期。
2016 年 5 月 26 日国家食品药品监督管理总局发布的《总局关于落实<国务院办公厅关于开展仿制药质量和疗效一致性评价的意见>有关事项的公告(2016 年第106 号)》中规定 2007 年 10 月 1 日前批准上市的列入《国家基本药物目录(2012年版)》中的化学药品仿制药口服固体制剂,原则上应在 2018 年底前完成一致性评价。
发行人作为全球领先的药品研发服务平台型公司具有得天独厚的优势。本公司建设仿制药一致性评价中心能够满足我国未来仿制药一致性评价的高标准的市场需要。
(3) 项目建设对我国用药安全、推动医药产业升级等方面具有积极意义
我国仿制药一致性评价从医保支付、药品注册等多方面对制药企业提出了要求。通过仿制药一致性评价,将提高药品质量,保障用药安全;提高医保资金使用效率,控制医保费用支出;提高企业工艺和质量水平升级,推动产业升级。
目前,我国大部分的制药企业不具备独立完成仿制药一致性评价的能力,需要依赖于 CRO 公司完成。因此,本公司仿制药一致性评价中心的建设项目将助力仿制药一致性评价工作的推进,对我国用药安全及医药产业升级等方面都具有重要意义。
3、募集资金具体用途与发行人现有主要业务之间的关系
发行人拥有中国第一家全面通过国家食药监局、FDA、GLP 核查的生物分析实验室,长期与国家食药监局及临床研究中心有良好合作,发行人合作伙伴已涵盖国内多家仿制药企业。
本公司目前可提供仿制药评价的一体化综合性服务:(1)仿药一致性测试服务;(2)仿制药制剂优化;(3)临床资源及配套服务。
本项目主要是对本公司的业务进行扩展,增强本公司的综合服务能力, 同时也是适应我国仿制药一致性评价的需要,为国内更多制药企业提供高质量的仿制药一致性评价服务。
4、项目前景分析
(1) 我国仿制药一致性评价的发展现状
随着各类关于仿制药一致性评价政策文件的发布,我国仿制药一致性评价的重要性逐渐提高。截至目前,我国药品的一致性评价至少包含三个评价内容:① 体外药学一致,主要指药品的理化性质如活性成分、剂型、规格用法用量和适应症等,可以通过体外溶出试验进行评价;②体内生物利用度一致,主要指口服药物进入人体后药物代谢动力学的一致,可以通过生物等效性试验进行评价;③临床疗效一致,即治疗效果的一致,必须通过和原研药的临床试验对比才能得出疗效一致的结论。
(2) 我国仿制药一致性评价市场容量推算
借鉴美国、日本的仿制药一致性评价历程,可以推断未来我国药品会分批陆续纳入评价范畴。第一批纳入的为 2007 年 10 月 1 日前批准上市列入《国家基本药物目录(2012 版)》中的化学药品仿制药口服固体制剂,原则上需在 2018 年底前完成仿制药的一致性评价,第一批仿制药一致性评价涉及药品 289 个。截至2017 年 3 月 1 日共有药品注册批文为 18,079 个。假设将有 20%的药品注册批文会纳入一致性评价,据此测算约有 3,600 条批文口服固体制剂批文纳入一致性评价范畴。
目前一个产品完成一致性评价的花费在 300 万以上,据此推算,上述 3,600 条口服固体制剂批文若完成国产口服固体制剂化学药产品仿制药一致性评价,预计市场容量在 100 亿元人民币左右。其中相当一部分一致性评价需要通过 CRO 公司完成,市场需求较大。同时随着后续其他剂型化学药仿制药纳入仿制药一致性评价范围,市场将会进一步扩容。
5、投资概算情况
上述项目预计投资规模如下表所示:
单位:万元
序号 | 项目 | 投资金额 | 占比 |
1 | 设备购置费 | 16,110.00 | 53.70% |
2 | 工程建设费用 | 9,792.00 | 32.64% |
3 | 预备费 | 1,372.16 | 4.57% |
4 | 铺底流动资金 | 2,725.84 | 9.09% |
- | 合计 | 30,000.00 | 100.00% |
6、工艺技术方案
仿制药一致性评价的主要内容是要求仿制药在体外药学等效即体外溶出曲线一致与体内生物等效即体内生物利用度一致,从而达到治疗等效即临床疗效一致的目的。我国仿制药一致性评价的关键节点主要有以下几点:①参比药品的选择,②评价系统,③药学研究,④生物等效性试验,⑤申报问题,⑥评价通过后的风险管理。
仿制药一致性评价中心的一致性评价业务流程和本公司的服务内容如下图所示:
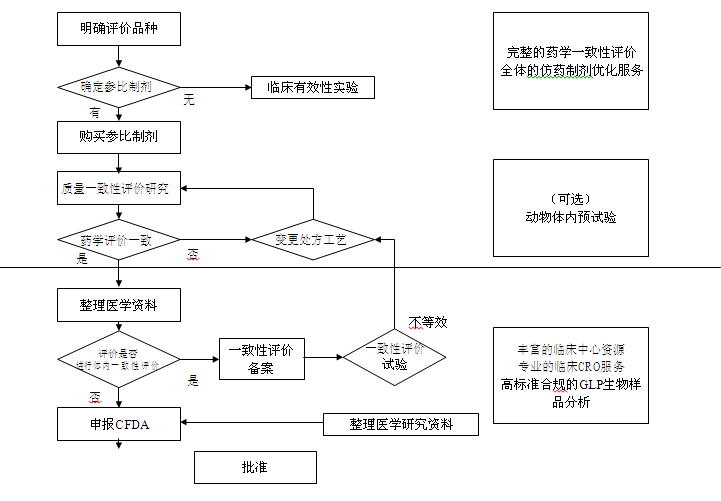
7、项目主要设备选择
(1)设备选择
本项目设备方案是建设单位经过多次调研、分析、对比后而确定的,设备技术含量高、性能稳定、技术成熟、价位适中,可以满足该项目业务发展的要求, 符合“先进、合理、经济”的原则。项目主要设备如下:
设备名称 | 拟采购来源 |
质谱仪 6500 plus | AB Sciex LLC |
设备名称 | 拟采购来源 |
质谱仪 6600 | AB Sciex LLC |
超高效液相色谱 | Shimadzu (hong Kong) Limited |
气相质谱联用仪 | Agilent Technologies Singapore (Sales) Pte Ltd |
全自动血液分析仪 | MEGA ( HONG KONG ) INDUSTRY LIMITED |
全自动凝血分析仪 | MEGA ( HONG KONG ) INDUSTRY LIMITED |
流式细胞分析仪 | MEGA ( HONG KONG ) INDUSTRY LIMITED |
全自动酶免分析仪 | MEGA ( HONG KONG ) INDUSTRY LIMITED |
药代信息管理软件LIMS | NeoTridentTechnology Ltd |
液体工作站 | HOLLY LIFE INTERNATIONAL TECHNOLOGY &TRA |
Electronic Lab Notebook 软件 | 北京创腾科技有限公司 |
显微镜 | OCCULT INTERNATIONAL LTD. |
凝血分析仪 | VASTEC MEDICAL LIMITED |
低温保存箱 | 上海华耀贸易有限公司 |
8、原辅材料及能源的供应
(1) 主要原辅材料供应
本项目建成后,主要提供研发类服务,使用的原辅材料数量较少,主要是少量化学溶剂和反应试剂,可以通过市场正常采购。
在原材料采购时应严格按照采购控制程序进行,对采购过程及供货厂商进行管理,并定期对供货质量及服务质量进行评审,以保证供货的质量。
(2) 主要能源供应
本项目所需的自来水和用电均由所在园区市政系统提供,纯化水由厂内制水系统自给。项目所在的园区具有完善的基础设施,本项目所需的自来水、电力均供应充足,技术参数和供应能力均能满足企业的生产要求。
9、项目实施进度安排
本项目总建设期为 2 年,根据项目特点、工程量和现有实施条件,项目的实施进度计划安排如下:
序号 |
进度 | 第一年 | 第二年 | ||||||
1-3 月 | 4-6 月 | 7-9 月 | 10-12 月 | 1-3 月 | 4-6 月 | 7-9 月 | 10-12 月 | ||
1 | 项目前期准备及备案 | ||||||||
2 | 初步设计及施工图设 计 | ||||||||
3 | 土建及装修改造 | ||||||||
4 | 公用工程及附属设施 建设 | ||||||||
5 | 设备购置及安装 | ||||||||
6 | 人员招聘、培训 | ||||||||
7 | 系统调试与试运行 | ||||||||
8 | 竣工验收并通过相关 认证 | ||||||||
10、项目环境保护
本项目将严格遵照标准操作规程、使用符合废物处理与治理的设备。
(1) 废水
预计本项目正常运营期内的实验用纯水量约 15 吨/年,纯水在实验过程进入实验室废液作为危险废物处置,经高温杀菌后委托有资质单位处理,不外排。制纯水弃水水质简单,可直接接入市政污水管网进城南污水处理厂集中处理。生活污水接入市政污水管网进吴中区城南污水处理厂集中处理,处理达标后最终对外排放。
(2) 废气与粉尘
本项目运营过程中由于使用少量化学溶剂进行试验,部分工序可能有微量挥发气体产生,对此部分气体需过滤净化处理达标后排放,按照有关规定设置处理装置,处理达标后进行排放。
(3) 固体废弃物
本项目固体废弃物主要是来自一次性耗材、固态实验室废液、固态含血清废液、废弃包装物、清洗杂物等,将分别委托由专业的固废处理公司和医疗废物处理公司做无害化处理。
11、项目选址
本项目建设地址位于某市区,租用厂房,租赁建筑面积 10,880 平方米,租赁期 10 年。
12、项目进展情况
截至本招股说明书签署日,本项目处于前期设计阶段。
13、项目的经济效益指标分析
项目建成达产后预计实现年均营业收入 30,000.00 万元,年均净利润 6,761.16万元,税后内部收益率 24.93%,税后投资回收期(含建设期) 5.57 年。